В 2022 году было опубликовано исследование (https://pubmed.ncbi.nlm.nih.gov/35814366/) с участием 50 женщин старше 30 лет с рецидивирующими инфекциями ВПЧ высокого онкогенного риска.
Пациенты были разделены на 2 группы: первая группа в течение 12 месяцев принимала ежедневно экстракт шиитаке, вторая — получала плацебо. Каждые 3 месяца испытуемые сдавали анализы на ВПЧ и иммунные маркеры. По завершении 12-месячного периода группе плацебо было предложено продолжить исследование и получать экстракт шиитаке в течение 6 месяцев.
В результате:
1. В первой группе, получавшей экстракт шиитаке — у 14 из 22 пациенток через 6 месяцев был выявлен отрицательный результат по ВПЧ.
2. В группе плацебо — у 12 пациентов, решивших продолжить исследование и принимать экстракт шиитаке, через 6 месяцев приема анализ на ВПЧ был отрицательным.
Экстракт шиитаке показал высокую активность в отношении онкогенных штаммов ВПЧ, увеличивая количество NK-клеток (естественных киллеров) и, таким образом, предотвращая развитие опухолей, которые могут быть вызваны ВПЧ инфекцией.
Показания к применению шиитаке:
• Доброкачественные и злокачественные новообразования (профилактика и дополнение к основной терапии).
• Вирусные заболевания (грипп, герпес, ВПЧ).
• Грибковые и бактериальные инфекции.
• Заболевания сердечно-сосудистой системы.
• Заболевания ЖКТ (нарушения пищеварения, дисбиоз).
• Нарушения углеводного обмена, метаболические заболевания.
• Заболевания женской репродуктивной системы.
• Антивозрастное средство.
* * * * * * *
НАУЧНАЯ РАБОТА. Н.Н. Ильинских, Л.Б. Глухова, Е.Н. Ильинских, Р.А. Карначук
ЦИТОЛОГИЧЕСКИЕ И ЦИТОГЕНЕТИЧЕСКИЕ ИЗМЕНЕНИЯ Т-ЛИМФОЦИТОВ КРОВИ ЧЕЛОВЕКА при воздействии противоопухолевого препарата адриамицина на фоне введения противоопухолевого препарата адриамицина на фоне введенияэкстрактов из мицеляи грибов ШИИТАКЕ (LENTINULA EDODES)
Изучена способность экстрактов из мицелия гриба (Lentinula edodes), выращенного в течение 10 сут в темноте, оказывать протек-тивное действие при воздействии на Т-лимфоциты человека в условиях in vitro противоопухолевым препаратом адриамицином. Установлена способность экстрактов стимулировать бласттрансформацию и митотическую активность Т-лимфоцитов. После воздействия адриамицином на фоне введения экстрактов мицелия гриба в культурах Т-лимфоцитов наблюдалось существенное снижение числа большинства патологически измененных клеток, индуцированных противоопухолевым препаратом.
Ключевые слова: Т-лимфоциты in vitro; адриамицин; мицелий Lentinula edodes; бласттрансформация; митотическая активность.
К числу наиболее грозных осложнений современной химиотерапии опухолей относится токсическая гипоплазия кроветворения. Практически все известные в настоящее время цитостатики даже в терапевтических дозах оказывают угнетающий эффект на гемопоэз, что вынуждает клиницистов осуществлять химиотерапию онкологических больных при постоянном контроле картины крови и в случае необходимости прерывать лечение [1].
Особое значение в указанном аспекте имеет исследование механизмов повреждающего действия цитостати-ков на генетические структуры гемопоэтических клеток нормального (не пораженного опухолью) костного мозга, поскольку известно, что большинство используемых в клинике цитостатических лекарств обладают выраженным цитогенетическим эффектом, который во многом и определяет токсическое действие этих препаратов на нормальные органы и ткани организма [1, 2].
Адриамицин (адриабластин, доксорубицин) относится к группе антрациклиновых антибиотиков — пигментов с индикаторными свойствами. По химическому строению антрациклины являются гликозидами. Кислотные свойства соединению придает аминогруппа сахара, а основные свойства антрациклинов обусловлены гидроксильными группами агликона.
Хромофорная группа препарата представляет собой красный нерастворимый в воде агликон-антрациклинон. В молекуле адриамицина агликон соединен гликозидной связью с аминосахаром даунозамином [2]. Адриамицин активен при лечении 18 форм злокачественных опухолей: лимфосаркомы, ретикулосаркомы, лимфогранулематоза, острых лейкозов, рака молочной железы, рака легкого, злокачественных опухолей яичника, сарком мягких тканей и некоторых костныех сарком, нейробла-стомы и опухоли Вильмса у детей, в отдельных случаях при раке щитовидной железы и переходно-клеточном раке мочевого пузыря и др. [3].
Шиитаке (ЬеМтийа edodes) – съедобный гриб, широко используемый как лекарственное средство. Имеются сведения о том, что потребление этого гриба снижает артериальное давление, уровень холестерина в крови, развитие сердечно-сосудистых заболеваний и возникновение раковых трансформаций клеток [4]. Его также стали использовать для предотвращения развития метастазов после хирургических операций раковых опухолей [5-7]. Экстракты из этого гриба в экспериментах на бактериях не обладали мутагенной активностью [8]. При этом Лима с соавт. [9] установили, что экстракты из гри-
ба обладают антимутагенной активностью при воздействии на эукариотические клетки мутагенов циклофос-фамида и №этил-Ы-нитрозомочевины [9].
Известны факты иммуностимулирующего действия компонентов этого гриба. Лентинан — полисахарид (3-
1,3-глюкагон), экстрагированный из грибов Lentinula edodes, обладает выраженой иммуностимулирующей активностью и применяется в клинической практике США и Японии начиная с 1986 г. [5—7]. Установлено, что лентиниан существенно стимулирует Т-систему иммунитета человека.
В настоящее время широко дискутируется возможность применения экстрактов гриба шиитаке и отдельных его метаболитов в качестве лекарственного средства, позволяющего снизить генетические эффекты, которые вызывает химиотерапия больных раком [10].
Цель настоящей работы — изучение в условиях in vitro цитогенетических последствий воздействия на Т-лимфоциты человека противоопухолевого препарата адриамицина на фоне введения в культуры экстрактов мицелия гриба шиитаке (Lentinula edodes).
Материал и методики исследования
Из мицелия гриба Lentinula edodes был получен экстракт, который стерилизовали, пропуская через миллипо-ровый фильтр с диаметром пор 3 мк. Концентрация сухого вещества в 1 мл экстракта составила 20 мг.
В культуры лимфоцитов периферической крови, полученные от здоровых доноров, вводили экстракты гриба шиитаке (Lentinula edodes) в дозе 0,1 мл на 1 мл культуральной среды RPMI и инкубировали на протяжении 72 ч в стандартных условиях [11].
Предварительно в пробит-анализе было показано, что данная доза экстракта не вызывает цитопатическо-го эффекта в условиях культуры Т-лимфоцитов человека. В культуральные флаконы через 12 ч после начала культивирования был введен цитостатический препарат адриамицин в дозе 1 мкг/мл. Эта доза цитостатика, по нашим данным, вызывает выраженный цитогенетический эффект, индуцируя повышение числа клеток с микроядрами [12].
На 72-м часу культивирования Т-лимфоциты фиксировали и готовили стандартные препараты по ранее описанному методу с анализом кариопатологических изменений интерфазного ядра и делящихся Т-лимфо-цитов [13].
В настоящей работе выполнено измерение площади ядер Т-лимфоцитов по методу, описанному в [14], с использованием компьютерной программы ImageJ, разработанной Wayne Rasband, National Institutes of Health, USA, и микроскопа фирмы «Zeiss Jena», оборудованного видеокамерой, а также проведен анализ бласттрансформации и митотической активности культур клеток.
Статистическую обработку осуществляли с использованием пакета статистических программ STATIS-TICA v.6.0, BIOSYS-2, Microsoft Access, BIOSTAT (Primer of Biostatistic version 4.03).
Все количественные показатели исследования обрабатывали с применением ¿-критерия Стьюдента для независимых выборок, поскольку тестирование закона распределения при помощи критерия Колмогорова — Смирнова не выявило отличий от нормального. Анализ статистических различий качественных признаков производили с использованием теста X с поправкой Йейтса на непрерывность [15].
Различия сравниваемых результатов (Х±т, где X — выборочное среднее арифметическое, т – ошибка среднего арифметического) считались статистически значимыми при достигнутом уровне р < 0,05.
Т а б л и ц а 1:
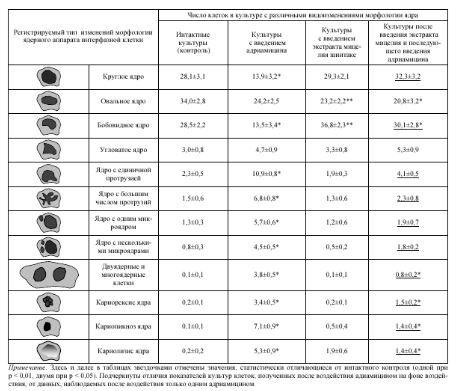
Частота клеток с различными морфологическими изменениями ядра в культурах Т-лимфоцитов крови после воздействия адриамицином на фоне введения экстрактов мицелия гриба шиитаке ^епйпиШ edodes), % (Х±т)
Число клеток в культуре с различными видоизменениями морфологии ядра
Регистрируемый тип изменений морфологии ядерного аппарата интерфазной клетки Интактные культуры (контроль) Культуры с введением адриамицина Культуры с введением экстракта мицелия шиитаке Культуры после введения экстракта мицелия и последующего введения адриамицина
ш Круглое ядро 28,1±3,1 13,9±3,2* 29,3±2,1 32,3±3,2
(•) Овальное ядро 34,0±2,8 24,2±2,5 23,2±2,2** 20,8±3,2*
Бобовидное ядро 28,5±2,2 13,5±3,4* 36,8±2,3** 30,1±2,8*
Угловатое ядро 3,0±0,8 4,7±0,9 3,3±0,8 5,3±0,9
fè) Ядро с единичной протрузией 2,3±0,5 10,9±0,8* 1,9±0,3 4,1±0,5
Ядро с большим числом протрузий 1,5±0,6 6,8±0,8* 1,3±0,6 2,3±0,8
Ядро с одним микроядром 1,3±0,3 5,7±0,6* 1,2±0,6 1,9±0,7
•• Ядро с несколькими микроядрами 0,8±0,3 4,5±0,5* 0,5±0,2 1,8±0,2
Двуядерные и многоядерные клетки 0,1±0,1 3,8±0,5* 0,1±0,1 0,8±0,2*
Кариорексис ядра 0,2±0,1 3,4±0,5* 0,2±0,1 1,5±0,2*
Кариопикноз ядра 0,1±0,1 7,1±0,9* 0,5±0,4 1,4±0,4*
0 Кариолизис ядра 0,2±0,2 5,3±0,9* 1,9±0,6 1,4±0,4*
Примечание. Здесь и далее в таблицах звездочками отмечены значения, статистически отличающиеся от интактного контроля (одной при р < 0,01, двумя при р < 0,05). Подчеркнуты отличия показателей культур клеток, полученных после воздействия адиамицином на фоне воздействия, от данных, наблюдаемых после воздействия только одним адриамицином.
Результаты исследования и обсуждение
Для интактных культур (табл. 1) Т-лимфоцитов было характерно то, что подавляющее большинство клеток (около 90%) имеет округлое ядро (круглое, овальное или бобовидное). Анализ морфологических изменений ядер Т-лимфоцитов под влиянием введения адриамицина свиде-
тельствует об изменениях отдельных классов клеток по этому показателю. На фоне снижения числа клеток с округлым ядром существенно возрастают патологические изменения морфологии ядер отдельных клеток: с протру-зиями, микроядрами и деструктивными изменениями, приводящими к гибели клетки, такими как кариорексис, ка-риопикноз и кариолизис (во всех случаях р < 0,01).
Наряду с этим отмечено также увеличение числа двуядерных клеток. Экстракты гриба шиитаке не вызывали появления патологических изменений ядер, но достоверно увеличивали в культуре число клеток с бобовидным ядром, при этом снижалось количество клеток с овальным ядром (в обоих случаях p < 0,05). Добавление в культуры адриамицина на фоне введения экстракта мицелия гриба существенно снижает, по сравнению с культурами, где был введен адриамицин без предварительного воздействия экстрактами, число клеток с патологиями ядра. Кроме того, снижается до ин-тактного уровня количество клеток с микроядрами, а
Частота патологических митозов в после воздействия адриамицином на фоне введения экс’
также с кариопикнозом и кариорексисом, при этом повышенным остается число двуядерных клеток и клеток с единичными протрузиями ядер и кариолизисом.
Анализ патологий деления (табл. 2) при воздействии адриамицином показал, что более 40% изученных митозов имеют патологические изменения.
Чаще всего наблюдались метафазы с отставаниями отдельных хромосом, а также многогрупповые метафазы. Среди патологических ана-телофаз преобладали клетки с отставаниями хромосом и мостами. Увеличения числа клеток с колхициноподобными митозами (К-митозами) не отмечено.
Т а б л и ц а 2:
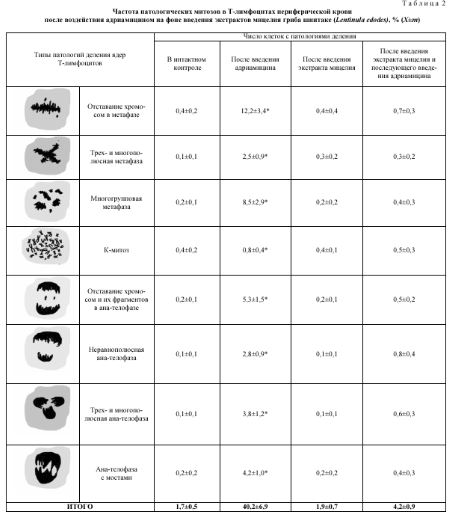
Т-лимфоцитах периферической крови
грактов мицелия гриба шиитаке (Lentinн/a edodes), % (Х±т)
Число клеток с патологиями деления
Типы патологий деления ядер Т-лимфоцитов В интактном контроле После введения адриамицина После введения экстракта мицелия После введения экстракта мицелия и последующего введения адриамицина
Отставание хромосом в метафазе 0,4±0,2 12,2±3,4* 0,4±0,4 0,7±0,3
Трех- и многополюсная метафаза 0,1±0,1 2,5±0,9* 0,3±0,2 0,3±0,2
а? Многогруппов ая метафаза 0,2±0,1 8,5±2,9* 0,2±0,2 0,4±0,3
К-митоз 0,4±0,2 0,8±0,4* 0,4±0,1 0,5±0,3
СІ Отставание хромосом и их фрагментов в ана-телофазе 0,2±0,1 5,3±1,5* 0,2±0,1 0,5±0,2
Неравнополюсная ана-телофаза 0,1±0,1 2,8±0,9* 0,1±0,1 0,8±0,4
V Трех- и многополюсная ана-телофаза 0,1±0,1 3,8±1,2* 0,1±0,1 0,6±0,3
Ана-телофаза с мостами 0,2±0,2 4,2±1,0* 0,2±0,2 0,4±0,3
ИТОГО 1,7±0,5 40,2±6,9 1,9±0,7 4,2±0,9
Если адриамицин существенно снижает митотическую активность культур клеток, подавляя бласттранс-формацию Т-лимфоцитов, то экстракты гриба шиитаке при введении в культуры более чем в 2 раза усиливают митотическую активность этих клеток (табл. 3), при этом достоверно увеличивая в культурах и процессы бласттрансформации Т-лимфоцитов.
Установлено, что адриамицин индуцировал снижение общей площади культивируемых клеток, при этом экстракты гриба шиитаке, наоборот, способствовали резкому возрастанию числа крупных клеток, площадь которых достигает более 100 мк2 (рис. 1).
Антимутагенные эффекты экстрактов мицелия шиитаке могут быть связаны с влиянием на следующие процессы в культурах Т-лимфоцитов:
1) стимуляция ДНК-репаративных процессов;
2) инактивирование мутагенных потенций адриа-мицина;
3) защита цитогенетических структур клетки от мутагенного действия адриамицина;
4) стимуляция апоптотических процессов;
5) активация лимфоцитов-киллеров по устранению генетически дефектных клеток [16].
Известно, что механизм противоопухолевого действия адриамицина связан с индуцированием в клетках свободных радикалов, что вызывает поражение ДНК на стадиях S и G2 [1, 13].
Наличие ана-телофаз с мостами свидетельствует о способности адриамицина к перестройкам с формированием дицентрических хромосом.
Т а б л и ц а 3:
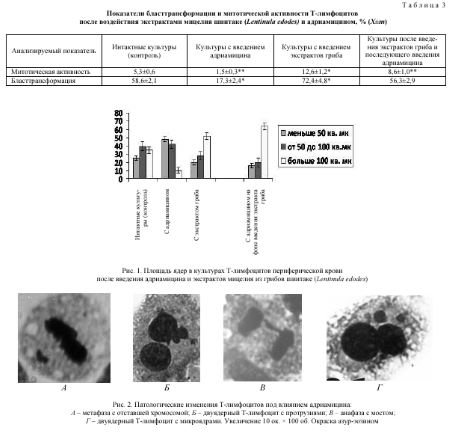
Показатели бласттрансформации и митотической активности Т-лимфоцитов после воздействия экстрактами мицелия шиитаке (ЬепйпиШ edodes) и адриамицином, % (Х±т)
Анализируемый показатель Интактные культуры (контроль) Культуры с введением адриамицина Культуры с введением экстрактов гриба Культуры после введения экстрактов гриба и последующего введения адриамицина
Митотическая активность 5,3±0,6 1,5±0,3** 12,6±1,2* 8,6±1,0**
Бласттрансформация 58,6±2,1 17,3±2,4* 72,4±4,8* 56,3±2,9
Рис. 1. Площадь ядер в культурах Т-лимфоцитов периферической крови после введения адриамицина и экстрактов мицелия из грибов шиитаке (ЬепНпи1а edodes)
Рис. 2. Патологические изменения Т-лимфоцитов под влиянием адриамицина:
А – метафаза с отставшей хромосомой; Б – двуядерный Т-лимфоцит с протрузиями; В – анафаза с мостом; Г – двуядерный Т-лимфоцит с микроядрами. Увеличение 10 ок. х 100 об. Окраска азур-эозином
Известна способность экстрактов шиитаке стимулировать лимфоциты-киллеры [18], и мы полагаем, что это может способствовать устранению из культуры генетически дефектных клеток [16].
Появление после совместного воздействия экстрактов и адриамицина клеток с кариорексисом и кариопикнозом, по-видимому, свидетельствует в пользу этой гипотезы, а наблюдаемое повышение
числа клеток с кариолизисом возможно объяснить активацией апоптотических процессов под влиянием компонентов экстрактов грибов шиитаке в условиях культуры клеток.
Заключение
Таким образом, полученные данные свидетельствуют, что в культурах Т-лимфоцитов, полученных от здоровых доноров, противоопухолевый препарат адриамицин способен индуцировать разнообразные цитологические и цитогенетические изменения. Некоторые из них, такие как отставание хромосом, формирование микроядер способствуют утрате части цитогенетического материала, а кариорексис, кариопикноз и кариолизис — гибели измененных клеток. Введение адриамицина на фоне предварительного введения экстрактов мицелия грибов шиитаке (Lentinula edodes) вызывает существенно меньшие цитопатический и цитогенетический эффекты, что свидетельствует о про-тективном действии некоторых компонентов гриба.
* * * * * *
Морфологические особенности роста мицелия и плодоношения некоторых штаммов съедобного ксилотрофного базидиомицета Lentinus edodes
Были исследованы отличия в вегетативном росте и образовании плодовых тел 10 штаммов ксилотрофного базидиомицета Lentinus edodes (шиитаке): F-249, 2-Т, 0779, 4080, 84-siit, 58-siit, M-370, Ny, Ner и Poot. Изучены морфолого-культуральные признаки и ростовые характеристики мицелия, а также сроки плодоношения и урожайность вышеперечисленных штаммов. Полученные результаты дают возможность использования данных сведений в практике грибоводства.
* * * * * *
УДК 577.124:577.125.3
ИЗМЕНЕНИЯ УГЛЕВОДНОГО И ЖИРНОКИСЛОТНОГО СОСТАВА МИЦЕЛИЯ LENTINUS EDODES ПРИ СОВМЕСТНОМ КУЛЬТИВИРОВАНИИ AZOSPIRILLUM BRASILENSE
Е.А. Лощинина, О.М. Цивилева, О.Е. Макаров, В.Е. Никитина
ФГБУН Институт биохимии и физиологии растений и микроорганизмов Российской академии наук, 410049, Саратов, проспект Энтузиастов, 13, loshchinina@yandex.ru, tsivileva@ibppm.sgu.ru.
Ранее нами впервые было показано стимулирующее влияние бактерий Azospirillum brasilense на культивируемый ксилотрофный базидиомицет Lentinus edodes. В данной работе мы изучили изменения углеводного и жирнокислотного состава мицелия L. edodes при культивировании в ассоциации с A. brasilense. Обнаружено, что в совместной культуре наблюдается значительное увеличение содержания полиола маннита по сравнению с чистой культурой: на стадии коричневой мицелиальной пленки – более чем в 30 раз, на стадии белого мицелия и примордия – в 3 раза. Содержание насыщенных жирных кислот мицелия L. edodes (С 16:0 и С 18:0) в совместной культуре оказалось соответственно в 1,7 и 1,9 раз ниже по сравнению с монокультурой гриба. Изменения состава мицелия в бактериально-грибной ассоциации по сравнению с монокультурой гриба оказались качественно схожи с соответствующими биохимическими изменениями, происходящими в мицелии шиитаке при переходе к генеративной стадии развития. Табл. 1. Библиогр.18 назв.
Ключевые слова: культивирование микробной ассоциации, ксилотрофные базидиомицеты, Azospirillum brasilense, Lentinus edodes, углеводный состав, жирнокислотный состав.
CHANGES IN CARBOHYDRATE AND FATTY-ACID CONTENT OF LENTINUS EDODES MYCELIUM IN DUAL CULTURES WITH AZOSPIRILLUM BRASILENSE
E.A. Loschinina, O.M. Tsivileva, O.E. Makarov, V.E. Nikitina
Institute of Biochemistry and Physiology of Plants and Microorganisms RAS,
13, Entuziastov Ave., Saratov, 410049, Russia, loshchinina@yandex.ru, tsivileva@ibppm.sgu.ru.
Earlier we have demonstrated for the first time a positive influence exerted by Azospirillum brasilense bacteria on the cultivable xylotrophic basidiomycete Lentinus edodes. In the present work, we have studied the changes in carbohydrate and fatty-acid content of L. edodes mycelium under the conditions of its co-culture with A. brasilense. It was shown that in the dual culture, the considerable increase in mannitol level compared to monoculture takes place, namely by more than 30 times at the step of brown mycelial film, and by 3 times at the steps of white mycelium and primordia. Saturated fatty acids (С16:0 and С18:0) content in L. edodes mycelium in joint culture appeared to be by 1.7 and 1.9 times, respectively, lower compared to the mushroom monoculture. The changes in mycelium composition of dual culture in comparison with pure fungal mycelium were observed to be qualitatively similar to the corresponding biochemical modulations taking place in shiitake mycelium on going towards the generative development step. 1 table. 18. sources.
Keywords: co-culture, xylotrophic basidiomycetes, Azospirillum brasilense, Lentinus edodes, carbohydrate composition, fatty-acid composition.
ВВЕДЕНИЕ
Lentinus edodes (шиитаке) – съедобный культивируемый базидиомицет, занимающий второе место в мире по объему промышленного производства среди грибов и обладающий ценными питательными и целебными свойствами [1-3]. Большое значение имеет вопрос о возможной оптимизации искусственного выращивания этой культуры. Улучшить технологию культивирования шиитаке, усилив скорость роста и одновременно подавив рост контаминантов можно путем выращивания гриба в ассоциации со стимулирующими рост микроорганизмами.
Бактерии рода AzospirШum, представители группы ризосферных бактерий – ассоциативные азотфиксаторы, стимулирующие рост и развитие растений посредством фиксации атмосферного азота и гормональной регуляции [4,5], обладающие бактерицидной и фунгицидной активностью в отношении ряда бактерий и микроскопических грибов [6-8].
Ранее нами впервые показано, что культивирование базидиомицета Lentinus edodes в ассоциации с бактериями AzospirШum brasilense приводит к стимуляции мицелиального роста и снижению
биотического влияния на шиитаке контаминантов [9]. Стимуляция роста шиитаке под влиянием азо-спирилл неизбежно должна сопровождаться изменениями в биохимическом составе мицелия. Углеводный и жирнокислотный состав – одни из важнейших характеристик грибной культуры, тесно связанные с физиологическим состоянием грибного организма. В связи с этим цель данного исследования состояла в изучении возможных изменений, происходящих в составе пула углеводов и жирных кислот мицелия шиитаке при культивировании гриба в ассоциации с азоспириллой.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Основным объектом исследования послужил штамм 1впИпиз вбобвз F-249 из коллекции высших базидиальных грибов кафедры микологии и альгологии МГУ. Культуру гриба поддерживали на сусло-агаре (4° по Баллингу) при 4 °С. Также в работе был использован штамм ЛюврИНит ЬгазИвпвв Sp7, полученный из Института микробиологии РАН (г. Москва).
Для культивирования I вdodвs в ассоциации с Л. brasilвnsв использовали синтетическую среду следующего состава (г/л): О-глюкоза – 10; 1-аспарагин – 1; KH2PO4 – 2; K2HPO4 – 3; MgSO4•7H2O – 2,5; FeSO4•7H2O – 0,03; CaCl2•7H2O – 0,02. К культуре I вdodвs, выращенной на жидкой среде указанного состава в течение 14 сут., подсевали суспензию бактерий Л. Ьга-silвnsв в физиологическом растворе (2х107 клеток/мл).
Экстракты из мицелия для определения углеводного состава получали, промывая биомассу дистиллированной водой. Для получения водного или этанольного экстракта отмытый и высушенный мицелий механически измельчали и трижды экстрагировали в течение 30 мин кипящей дистиллированной водой или этанолом соответственно. Экстракты объединяли и высушивали досуха.
Состав углеводной фракции мицелия I вdodвs исследовали методом капиллярной газовой хроматографии на неподвижной жидкой фазе SE-54 в режиме программирования температуры, с предварительным получением силильных производных сахаров.
Триметилсилиловые эфиры исследуемых проб и соединений-стандартов получали с использованием 1,1,1,3,3,3-гексаметилдисилазана и три-метилхлорсилана в качестве катализатора [10]. Навеску сухой пробы обрабатывали следующим образом. Растворяли 10 мг пробы в 1,5 мл безводного пиридина, добавляли 0,2 мл гексаметилдиси-лазана и 0,1 мл триметилхлорсилана с помощью автоматической пипетки. Добивались полного растворения реагентов путем встряхивания и нагрева на песчаной бане до температуры примерно 80 °С (по необходимости). Затем помещали пробы в центрифужные пробирки и заклеиваливали их лентой, обеспечивая минимальное попадание вла-
ги во время экспериментов во избежание гидролиза триметилсилиловых эфиров. Центрифугировали пробирки в течение 10 мин при 4500-5000 об./мин. Стеклянными капиллярами производился отбор прозрачного слоя, объем пробы в пробирках Эппендорфа составлял 1 мл.
Хроматографию проводили на приборе «Chrom 5» (ЧССР) с пламенно-ионизационным детектором, используя кварцевую капиллярную колонку длиной 25 м, при программировании температуры в пределах от 150 до 280 °С со скоростью нагрева термостата колонок 8 °С/мин. Объем пробы составлял 1 мкл. Газ-носитель – гелий. Времена удерживания компонентов анализируемых проб и интегральные площади пиков сопоставляли с соответствующими характеристиками стандартных веществ, хроматографирование которых проводили при идентичных условиях и параметрах газохроматографического процесса. Рассчитывали содержание каждого углевода в исследуемых пробах.
Липиды экстрагировали из мицелия модифицированным методом С. Song с соавт., включающим обработку сухого мицелия смесями метанол-в од а-хлороформ в объемном соотношении (1:2:3), высушивание в токе азота или аргона и экстракцию сухого остатка гексаном [11]. Жирные кислоты анализировали в виде метиловых эфиров методом газожидкостной хроматографии [12]. Метиловые эфиры жирных кислот разделяли на газожидкостном хроматографе «Биохром-1» на кварцевой капиллярной колонке (длина 25 м, внутренний диаметр 0,2 мм) с неподвижной фазой SE-54. Использовали режим программирования температуры термостата колонки от 130 до 270 °С со скоростью нагрева 4°С/мин. Температура испарителя -150 °С, детектора – 270 °С. Газ-носитель – гелий, скорость потока 1,6 мл/мин.
Жирные кислоты идентифицировали по временам удерживания их метиловых эфиров. В качестве стандартов метиловых эфиров жирных кислот использовали набор «Bacterial Acid Methyl Esters CP Mix» («Supelco»): 11:0; 2-OH 10:0; 12:0; 13:0; 2-OH 12:0; 3-OH 12:0; 14:0; i-15:0; a-15:0; 15:0; 2-OH 14:0; 3-OH 14:0; i-16:0; 16:19; 16:0; i-17:0; 17:0; 2-OH 16:0; 18:29,12 ;18:19 ;18:0; 19:0; 20:0, а также в дополнение другие метиловые эфиры ЖК («Sigma»): 7:0; 8:0; 9:0; 10:0; 18:1; 20:2; 21:0; 22:1; 22:0; 23:0; 24:1; 24:0.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Из биохимических особенностей грибного мицелия, в разных аспектах привлекающих внимание исследователей и определяющих способность ба-зидиомицета к плодоношению, важное место занимают его углеводный и жирнокислотный состав.
Ранее нами было обнаружено стимулирующее влияние бактерии A. brasilense на рост L. edodes. В настоящей работе высказано и подтверждено предположение, что стимуляция роста
шиитаке при совместном культивировании с азо-спириллой должна сопровождаться определенными изменениями химического состава мицелия и его биологической активности.
Углеводный состав мицелия совместной культуры L. edodes F-249 и AzospirШum brasilense Sp7 изучали в зависимости от стадии морфогенетиче-ского развития шиитаке: белый вегетативный мицелий, коричневая мицелиальная пленка (КМП), примордий, плодовое тело. Результаты анализа представлены в таблице. Анализируя данные таблицы, можно сказать, что количественное содержание углеводов на стадиях белого мицелия в чистой и совместной культурах, а также плодового тела при совместном культивировании с A. brasilense Sp7 выше в пиридин-растворимых фракциях мицелия, чем в аналогичных пробах водорастворимых фракций. Так, в плодовом теле пиридин-растворимых фракций мицелия присутствует глюкоза (0,82% от суммарного содержания углеводов) и мальтоза (3,58%). Этих соединений нет в водорастворимой фракции плодового тела, а содержание маннита более чем в 3 раза ниже по сравнению с пиридин-растворимой фракцией.
В мицелии во всех исследуемых нами пробах обнаружен водорастворимый полиол – маннит. При этом в совместной культуре наблюдается значительное увеличение содержания маннита по сравнению с чистой культурой. На стадии коричневой мицелиальной пленки смешанной культуры его более чем в 30 раз больше; на стадии белого мицелия и примордия – в 3 раза больше.
При рассмотрении особенностей углеводного состава шиитаке в случае плодоношения на коричневой мицелиальной пленке (результаты, ра-
нее полученные в нашей лаборатории) обращают на себя внимание выраженные количественные изменения О-маннита в зависимости от стадии морфогенеза. Содержание маннита в белом мицелии, пигментированном мицелии, мицелиаль-ной пленке и плодовом теле соотносится как 714:55:1:56 соответственно. Таким образом, маннит накапливается в белом мицелии перед плодоношением. Интересно, что те же последствия в плане изменения содержания маннита имеет низкотемпературный стресс.
Стадия плодового тела не получена в глубинной чистой культуре гриба на синтетической среде. Формирование базидиом наблюдали только в двойной культуре, что еще раз свидетельствует в пользу метода совместного культивирования L. edodes с А. brasilense Sp7 как фактора, положительно отражающегося на росте шиитаке.
Значимая часть компонентов химического состава мицелия базидиомицетов представлена ли-пидами, количество которых сильно варьирует в зависимости от условий роста [13]. Известно, что погруженный мицелий шиитаке образует до 20% липидов (плодовые тела 3-4%) [14]. Исследования жирнокислотного состава липидов L. edodes этими и другими авторами [11,15], более поздние исследования липидов других базидиомицетов [16,17] обнаружили ряд закономерностей, распространение и, возможно, универсальность которых предстоит выяснить в дальнейшем.
Исследованиям бактериально-грибной культуры предшествовало выявление изменений жирнокислотного состава общих липидов шиитаке на разных стадиях морфогенетического развития гриба. На примере штамма F-249 нами показано,
КМП маннит глюкоза фруктоза 4511 56124 2153 –
Примордий маннит глюкоза 56955 269 —
Двойная культура L. edodes Р-249 и А. brasilense Sp7
Белый мицелий маннит фруктоза 119831 37 33365 37
КМП маннит глюкоза фруктоза 142481 90320 10229 705
Примордий маннит глюкоза фруктоза 201974 68703 31898 2524
Плодовое тело маннит глюкоза мальтоза 87782 1077 45455 28289
что по мере развития вегетативного мицелия происходит постепенное снижение ненасыщенности жирных кислот, а также увеличение относительного содержания короткоцепочечных кислот [18]. На стадии образования плодовых тел отмечается заметное увеличение уровня ненасыщенных жирных кислот и отсутствие кислот с короткими цепями. Резкие изменения относительного содержания короткоцепочечных жирных кислот могут быть связаны с температурой культивирования шиитаке (развитие белого мицелия происходило при 26 оС, пигментация и образование коричневой мицели-альной пленки при 4 оС, развитие плодовых тел при 18 оС). Ранее отмечалось, что у базидиальных грибов, выращенных при низких температурах, наблюдается укорачивание ацильных цепей жирных кислот липидов [16].
Достаточно высокая для базидиальных грибов концентрация пальмитиновой кислоты С16:0 отличает I вdodвs от других ксилотрофов [14]. Основная массовая доля насыщенных жирных кислот мицелия приходится на гекса- и октадека-новую (С16:0 и С18:0). В условиях нашего эксперимента с монокультурой I. вdodвs F-249 уровень пальмитиновой кислоты (% от суммы жирных кис-
лот мицелия) изменялся от 14,3 на стадии белого мицелия до 23,8% на стадии коричневой мицели-альной пленки. В дальнейшем при образовании спорофоров I вdodвs степень насыщенности жирных кислот мицелия снижается. В совместной культуре содержание пальмитиновой и октадека-новой кислот было соответственно в 1,7 и 1,9 раз ниже по сравнению с чистой культурой гриба, то есть изменения и углеводного, и жирнокислотного состава мицелия в бактериально-грибной культуре по сравнению с монокультурой гриба оказались качественно схожи с соответствующими биохимическими изменениями мицелия перед плодоношением.
ВЫВОДЫ
Таким образом, изучение совместной культуры I вdodвs и Л. brasilвnsв позволило выявить некоторые особенности биохимического состава мицелия, характерные также для монокультуры шиитаке при переходе к генеративной стадии развития. Это явление может служить одним из аспектов объяснения обнаруженного нами стимулирующего влияния Л. brasilвnsв Sp7 на рост I вdodвs F-249.
БИБЛИОГРАФИЧЕСКИМ СПИСОК
1. Medicinal mushroom modulators of molecular targets as cancer therapeutics / B.-Z. Zaidman [and oth.]// Appl. Microbiol. Biotechnol. 2005. Vol. 67. № 4. P. 453-468.
2. An examination of antibacterial and antifungal properties of constituents of Shiitake (Lentinula edodes) and Oyster (Pleurotus ostreatus) mushrooms / R. Hearst [and oth.] // Complementary Therapies in Clinical Practice. 2009. Vol. 15, Issue 1. P. 5-7.
3. Wasser S.P. Current findings, future trends, and unsolved problems in studies of medicinal mushrooms // Appl. Microbiol. Biotechnol. 2011. Vol. 89. № 5. P. 1323-1332.
4. Bashan Y., de-Bashan L.E. How the Plant Growth-Promoting Bacterium Azospirillum Promotes Plant Growth -A Critical Assessment // Advances in Agronomy. 2010. Vol. 108. P. 77-136.
5. Steenhoudt O., Vanderleyden J. Azospirillum, a free-living nitrogen-fixing bacterium closely associated with grasses: genetic, biochemical and ecological aspects // FEMS Microbiology Reviews. 2000. Vol. 24, Issue 4. P. 487-506.
6. Red’kina T.V. Fungistatic Activity of Bacteria of the Genus Azospirillum // Agrokemia es Talajtan (Agrochemis-try and Soil Science). 1990. Vol. 39. № 3-4. P. 465-468.
7. Никитина В.Е. Лектины азоспирилл : свойства, биологическая активность и перспективы их практического использования : дис. … д-ра биол. наук. Саратов, 2001. 310 с.
8. Антимикробная и регенерирующая способность биокомпонентов гриба Lentinus edodes (шиитаке) /Е.В. Милькова [и др.] // Успехи медицинской микологии / под общ. науч. ред. акад. РАЕН Ю.В. Сергеева. М. : Национальная академия микологии, 2003. Т. I. С. 284-285.
9. Никитина В.Е., Цивилева О.М., Лощинина Е.А.
Взаимоотношения ксилотрофных базидиомицетов и почвенных азотфиксирующих бактерий рода Azospirillum // Успехи медицинской микологии / под общ. науч. ред. акад. РАЕН Ю.В. Сергеева. М. : Национальная академия микологии, 2006. Т. VII. С. 293-294.
10. Пецев Н., Коцев Н. Справочник по газовой хроматографии / пер. с болг. Муллера В.М.; под ред. В.Г. Березкина, К.И. Сакодынского. М. : Мир, 1987. 260 с.
11. Growth stimulation and lipid synthesis in Lentinus edodes / C.H. Song [and oth.] // Mycologia. 1989. Vol. 81. No. 4. P. 514-522.
12. Хроматография : практическое приложение метода / пер. с англ. А.В. Родионова; ред. пер. В.Г. Берез-кин; под ред. Э. Хефтмана. М. : Мир, 1986. : 422 с.
13. Беккер З.И. Физиология и биохимия грибов. М. : Изд-во МГУ, 1988. 227 с.
14. Липидный состав плодовых тел и глубинного мицелия Lentinus edodes (Berk.) Sing. [Lentinula edodes (Berk.) Pegler]/ Е.П. Феофилова [и др.] // Микробиология. 1998. № 5. Т. 67. С. 655-659.
15. Состав и биологическая активность глубинного мицелия ксилотрофного базидиомицета Lentinus edodes / А.Г. Лобанок [и др.] // Прикл. биохимия и микробиология. 2003. № 1. Т. 39. С. 69-73.
16. О различных механизмах биохимической адаптации мицелиальных грибов к температурному стрессу: изменения в составе липидов / Е.П. Феофилова [и др.] // Микробиология. 2000. № 5. Т. 69. С. 612-619.
17. Прорастание базидиоспор Agaricus bisporus / Е.П. Феофилова [и др.] // Прикл. биохимия и микробиология. 2004. № 2. Т. 40 С. 220-226.
18. Изменение жирнокислотного состава общих липидов и лектиновой активности Lentinus edodes в процессе морфогенеза / О.М. Цивилева [и др.] // Микол. и фитопатол. 2007. № 5. Т. 41. 450-455.
Поступило в редакцию 4 июля 2012 г
* * * * * *
Литература
1. Новицкий В.В., Переверзева Э.Р., Пономарков В.И. и др. Экспериментально клинические аспекты некоторых токсических эффектов противо-
опухолевых препаратов. М. : Изд-во ВНИИМИ, 1987. Сер. Онкология. Вып. 2. 69 с.
2. ДудникЮ.В., Гаузе Г.Ф. Механизмы действия антрациклинов // Экспериментальная онкология. М., 1982. Т. 4, № 5. С. 18-22.
3. Переводчикова Н.И. Клиническая химиотерапия опухолевых заболеваний. М. : Медицина, 1976. 200 с.
4. Wasser S.P., Weis A.L. Therapeutic effects of substances occurring in higher basidiomycetes mushrooms: a modem perspective // Crit. Rev. Immunol.
1999. Vol. 19, № 1. P. 65-96.
5. НовиковВ.И., Карандашов В.И., Сидорович И.Г. Иммунотерапия при злокачественных новообразованиях. М. : Медицина, 1999. 136 с.
6. Поливанов К.А. Предоперационная иммунокоррекция в хирургическом лечении заболеваний желудка : автореф. дис. … канд. мед. наук. М.,
2005. 18 с.
7. Shah S.K., Walker P.A., Moore-Olufemi S.D. et al. An evidence-based review of a Lentinula edodes mushroom extract as complementary therapy in
the surgical oncology patient // Journal of Parenteral. and Enteral. Nutrition. 2011. Vol. 35, № 4. P. 449-458.
8. Grüter A., Friederich U., Würgler F.E. Antimutagenic effects of mushrooms // Mutat. Res. 1990. Vol. 231, № 2. Р. 243-249.
9. Lima P.A., Delmanto R.D., SuguiM.M. et al. Lentinula edodes (Berk.) Pegler (shiitake) modulates genotoxic and mutagenic effects induced by alkylat-
ing agents in vivo//Mutat. Res. 2001. Vol. 496. № 1. P. 23-32.
10. Lindequist U., Niedermeyer T.H., Jülich W.D. The pharmacological potential of mushrooms // Evid. Based. Complement. Alternat. Med. 2005. Vol. 2, № 3. Р. 285-299.
11. Moorhead P.S., Novel P.C., Mellman W.J. et al. Chromosome preparations of leukocyte cultured from human peripheral blood // Exptl. Cell Res.
1960. Vol. 20. P. 613-516.
12. Ильинских Н.Н., Новицкий В.В., Ванчугова Н.Н., Ильинских И.Н. Микроядерный анализ и цитогенетическая нестабильность. Томск : Изд-во Том. ун-та, 1992. 272 с.
13. Ильинских Н.Н., Васильев С.А., Кравцов В.Ю. Микроядерный тест в скрининге и мониторинге мутагенов. Saarbrucken : Lambert Academic Publishing, 2011. 524 c.
14. ИльинскихИ.Н., Новицкий В.В., ИльинскихЕ.Н. и др. Инфекционная кариопатология. Томск : Изд-во Том. ун-та, 2005. 196 с.
15. Боровиков В.П., Боровиков И.П. Статистический анализ и обработка данных в среде Windows. М. : Филинъ, 1997. C. 608.
16. ИльинскихН.Н., ИльинскихИ.Н., БочаровЕ.Ф. Цитогенетический гомеостаз и иммунитет. Новосибирск : Наука, 1986. 250 с.
17. Shah S.K., Walker PA., Moore-Olufemi S.D. et al. An evidence-based review of a Lentinula edodes mushroom extract as complementary therapy in the
surgical oncology patient // Journal of Parenteral. and Enteral. Nutrition. 2011. Vol. 35, № 4. P. 449-458.
18. Terakawa N., Matsui Y., Satoi S. Immunological effect of active hexose correlated compound (AHCC) in healthy volunteers: a double-blind, placebocontrolled trial // Nutrition and Cancer. 2008. Vol. 60, № 5. 643-651.
19. Засухина Г.Д. Репаративные механизмы клеток и проблемы окружающей среды. М. : Наука, 1979. 183 с.
Статья представлена научной редакцией «Биология» 26 декабря 2011 г.