Ежовик гребенчатый. Про результаты.
ЕЖОВИК. Природный грибной ноотроп
Многим людям сейчас очень сложно сосредоточиться на работе — высокий уровень стресса, огромный поток информации, недосып и «осенняя хандра» сводят продуктивность на нет. Наш мозг нуждается в поддержке, и вряд ли есть гриб, который справится с этой задачей лучше, чем ежовик гребенчатый — рекордсмен по ноотропным свойствам.
В мае 2023 года группа ученых провела масштабный обзор более 100 научных исследований о свойствах ежовика. Статья, опубликованная на PubMed, (https://pubmed.ncbi.nlm.nih.gov/37233262/) содержит огромное количество подтвержденных фактов о ноотропном, нейропротекторном и дргугих полезных эффектах ежовика. Мы поделимся с вами самыми интересными из них:
• Эринацины и герициноны — уникальные соединения, содержащиеся только в ежовике, стимулируют (https://www.mdpi.com/2072-6643/11/4/715) нейрогенез (образование новых нервных клеток), в том числе в пожилом возрасте. Проникая (https://www.mdpi.com/1420-3049/24/8/1624) через гематоэнцефалический барьер, они оказываются в мозге уже через считанные часы после приема внутрь.
• Эринацин А стимулирует (https://www.mdpi.com/1422-0067/18/8/1659) фактор роста нервов (NGF), отвечающий за образование новых нейронных связей (ключевой механизм нейропластичности), защищает (https://www.sciencedirect.com/science/article/abs/pii/S0023643815301080?via%3Dihub) нервные клетки от гибели и улучшает (https://www.tandfonline.com/doi/full/10.1080/01616412.2018.1556494) способность аксонов к регенерации.
• Ежовик помогает устранить (https://www.sciencedirect.com/science/article/abs/pii/S2186495014000108?via%3Dihub) когнитивные нарушения, вызванные длительным приемом антидепрессантов.
• В ежовике высокое содержание (https://www.mdpi.com/1420-3049/24/19/3511) эрготионеина — сильнейшего антиоксиданта, который наш организм не вырабатывает самостоятельно. Исследования показали, что эрготионеин способен (https://www.sciencedirect.com/science/article/abs/pii/S027869151000606X?via%3Dihub) восстанавливать нарушения памяти, за счет подавления окислительного стресса.
БАД. Не является лекарственным препаратом. Перед применением необходима консультация специалиста.
* * * * * * *
ПОДРОБНО:
Химические компоненты Hericium erinaceus способствуют выживанию нейронов и потенцируют рост нейритов через путь TrkA/Erk1/2.
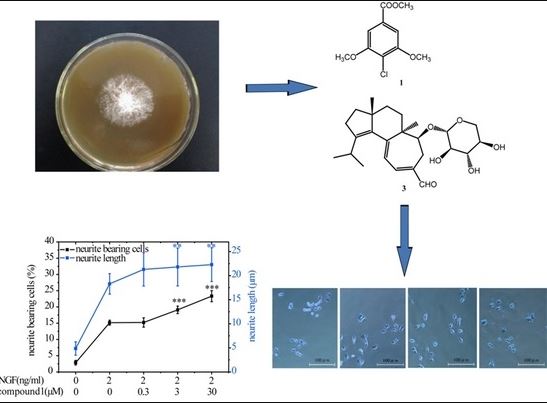
Графическая абстракция
1. Введение
2. Результаты и обсуждение.
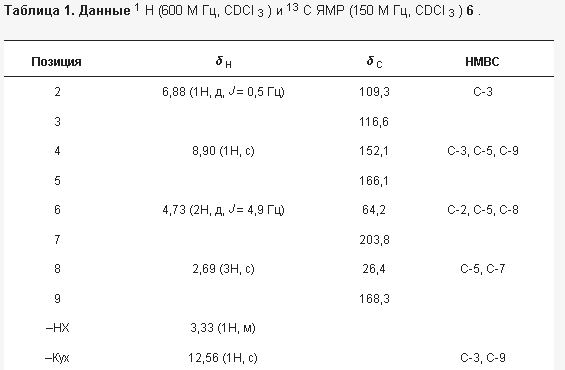
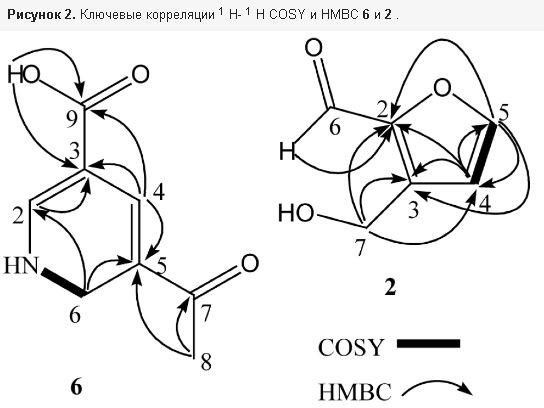
2.1. Структурное выяснение соединений 1–7
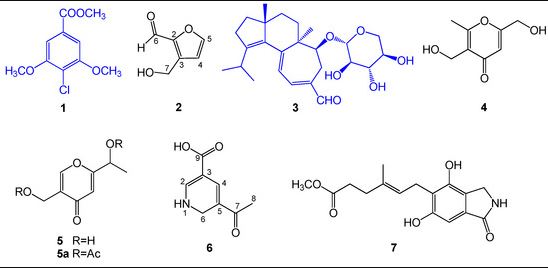
Рисунок 1. Структуры соединений 1 – 7 из Hericium erinaceus .
2.2. Соединения 1 и 3 способствуют индуцированному NGF росту нейритов в клетках PC12
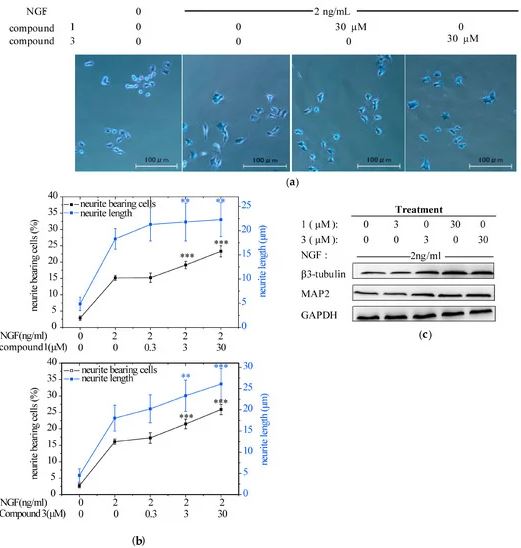
Рисунок 3.
2.3. Соединения 1 и 3 способствуют индуцированному NGF росту нейритов путем активации пути TrkA/Erk1/2 в клетках PC12.
2.3.1. Специфические ингибиторы TrkA и Erk1/2 снижают уровень соединений 1 и 3 , усиливая рост нейритов в клетках PC12.
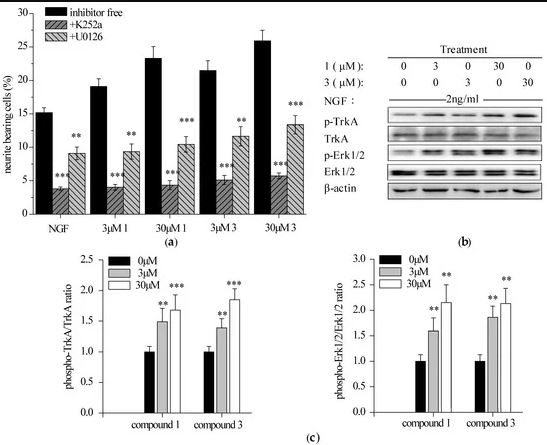
2.3.2. Соединения 1 и 3 усиливают индуцированное NGF фосфорилирование TrkA и Erk1/2 в клетках PC12.
2.4. Соединения 1 и 3 предотвратили гибель нейронально-дифференцированных клеток PC12 на фоне удаления NGF.
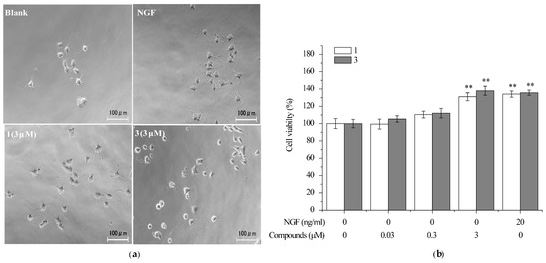
2.5. Соединение 3 индуцировало рост нейритов в первичных нейронах коры головного мозга крысы
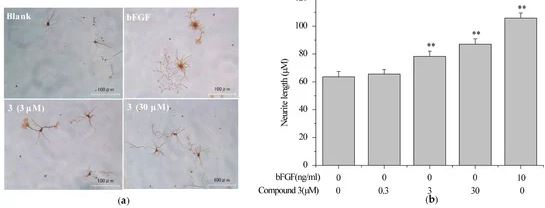
3. Материалы и методы.
3.1. Общие экспериментальные процедуры
3.2. Грибковые материалы
3.3. Извлечение и изоляция
3.4. Культура клеток
3.5. МТТ-анализ жизнеспособности клеток
3.6. Анализ роста нейритов клеток PC12
3.7. Вестерн-блоттинг-анализ
3.8. Иммуноцитохимическое окрашивание
3.9. Статистический анализ
4. Выводы
- Каплан, Д.Р.; Стивенс, Р.М. Передача сигнала нейротрофина с помощью рецептора Trk. Дж. Нейробиол. 1994 , 25 , 1404–1417. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Акаги, М.; Мацуи, Н.; Акаэ, Х.; Хирасима, Н.; Фукуиси, Н.; Фукуяма, Ю.; Акаги, Р. Непептидные нейротрофические агенты, полезные при лечении нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Дж. Фармакол. наук. 2015 , 127 , 155–163. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Тивари, СК; Чатурведи Р.К. Пептидная терапия при нейродегенеративных заболеваниях. Курс. Мед. хим. 2014 , 21 , 2610–2631. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Аллен, С.Дж.; Уотсон, Джей-Джей; Шумарк, Дания; Баруа, НУ; Патель, NK GDNF, NGF и BDNF как варианты лечения нейродегенерации. Фармакол. Там. 2013 , 138 , 155–175. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Сюй, CJ; Ван, Дж.Л.; Джин, В.Л. Новая терапевтическая роль NGF при болезни Альцгеймера. Нейрохим. Рез. 2016 , 41 , 1211–1218. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Ченг, X.; Харцдорф, Н.; Хаинг, З.; Канг, Д.; Камелио, AM; Шоу, Т.; Шмидт, CE; Сигел, Д. Рост нейронов, способствующий сесквитерпен-неолигнанам; синтезы и биологические исследования. Орг. Биомол. хим. 2012 , 10 , 383–393. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Ши, XW; Лю, Л.; Гао, Дж. М.; Чжан, А.Л. Циатановые дитерпены из китайского гриба Sarcodon scabrosus и их активность, способствующая росту нейритов. Евро. Дж. Мед. хим. 2011 , 46 , 3112–3117. [ Академика Google ]
- Гао, Дж. М. Новые биологически активные метаболиты высших грибов Китая. Курс. Орг. хим. 2006 , 10 , 849–871. [ Академика Google ]
- Лу, QQ; Тиан, Дж. М.; Вэй, Дж.; Гао, Дж. М. Биоактивные метаболиты мицелия базидиомицета Hericium erinaceum . Нат. Прод. Рез. 2014 , 28 , 1288–1292. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Тонгбай, Б.; Рапиор, С.; Хайд, К.Д.; Виттштейн, К.; Стадлер, М. Hericium erinaceus , удивительный лекарственный гриб. Микол. Прог. 2015 , 14 , 91–113. [ Академия Google ] [ CrossRef ]
- Фридман, М. Химия, питание и полезные для здоровья свойства плодовых тел и мицелия грибов Hericium erinaceus (Львиная грива) и их биоактивных соединений. Дж. Агрик. Пищевая хим. 2015 , 63 , 7108–7123. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Чжан, CC; Инь, Х.; Цао, Кипр; Вэй, Дж.; Чжан, К.; Гао, Дж. М. Химические компоненты Hericium erinaceus и их способность стимулировать опосредованный NGF рост нейритов на клетках PC12. Биоорг. Мед. хим. Летт. 2015 , 25 , 5078–5082. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Фан, CW; Дэвид, П.; Найду, М.; Вонг, К.Х.; Сабаратнам, В. Терапевтический потенциал кулинарно-лекарственных грибов для лечения нейродегенеративных заболеваний: разнообразие, метаболиты и механизмы. Крит. Преподобный Биотехнология. 2015 , 35 , 355–368. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Мори, К.; Обара, Ю.; Хирота, М.; Азуми, Ю.; Кинугаса, С.; Инатоми, С.; Накахата, Н. Активность Hericium erinaceus , индуцирующая фактор роста нервов, в клетках астроцитомы человека 1321N1. Биол. Фарм. Бык. 2008 , 31 , 1727–1732. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Лай, Польша; Найду, М.; Сабаратнам, В.; Вонг, К.Х.; Дэвид, РП; Куппусами, УР; Абдулла, Н.; Малек, СНА Нейротрофические свойства лекарственного гриба Львиная грива Hericium erinaceus (Высшие базидиомицеты) из Малайзии. Межд. Дж. Мед. Грибы 2013 , 15 , 539–554. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Мори, К.; Инатоми, С.; Оучи, К.; Азуми, Ю.; Тучида, Т. Улучшение воздействия гриба Ямабушитаке ( Hericium erinaceus ) на легкие когнитивные нарушения: двойное слепое плацебо-контролируемое клиническое исследование. Фитотер. Рез. 2009 , 23 , 367–372. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Мори, К.; Обара, Ю.; Мория, Т.; Инатоми, С.; Накахата, Н. Влияние Hericium erinaceus на дефицит обучения и памяти у мышей, вызванный бета-амилоидным пептидом (25–35). Биомед. Рез. 2011 , 32 , 67–72. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Вонг, К.Х.; Найду, М.; Дэвид, РП; Абдулла, Массачусетс; Абдулла, Н.; Куппусами, УР; Сабаратнам, В. Повышение функционального восстановления после повреждения малоберцового нерва грызунов грибом Львиная грива, Hericium erinaceus (Бюллетень: Фр.), Перс. (Афиллофоромицетидеа). Межд. Дж. Мед. Грибы 2009 , 11 , 225–236. [ Академия Google ] [ CrossRef ]
- Кавагиси, Х.; Чжуан К. Соединения Hericium erinaceum от деменции . Будущее наркотиков 2008 , 33 , 149–155. [ Академия Google ] [ CrossRef ]
- Тан, HY; Инь, Х.; Чжан, CC; Цзя, К.; Гао, Дж. М. Структурное разнообразие, синтез и биологическая активность циатандитерпеноидов у высших грибов. Курс. Мед. хим. 2015 , 22 , 2375–2391. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Ма, Би Джей; Шен, JW; Ю, HY; Руан, Ю.; Ву, ТТ; Чжао, X. Гериценоны и эринацины: стимуляторы биосинтеза фактора роста нервов (NGF) у Hericium erinaceus . Микология 2010 , 1 , 92–98. [ Академия Google ] [ CrossRef ]
- Шимбо, М.; Кавагиси, Х.; Ёкогоши, Х. Эринацин А увеличивает содержание катехоламинов и факторов роста нервов в центральной нервной системе крыс. Нутр. Рез. 2005 , 25 , 617–623. [ Академия Google ] [ CrossRef ]
- Чанг, Швейцария; Чен, Ю.; Да, ХХ; Чен, HX; Ким, JX; Чанг, CC; Пэн, CC; Пэн, Р.Ю. Повышение продуктивности эринацина А в мицелии Hericium erinaceus и его нейропротекторной биологической активности против апоптоза, вызванного глутаматом. LWT Food Sci. Технол. 2016 , 65 , 1100–1108. [ Академия Google ] [ CrossRef ]
- Ли, К.Ф.; Чен, Дж. Х.; Дэн, CC; Шен, Швейцария; Се, MC; Лу, CC; Ли, КЦ; Ли, Л.И.; Чен, В.П.; Чен, CC; и другие. Защитные эффекты мицелия Hericium erinaceus и выделенного из него эринацина А против гибели нейронов, вызванной ишемией-повреждением, посредством ингибирования iNOS/p38 MAPK и нитротирозина. Межд. Дж. Мол. наук. 2014 , 15 , 15073–15089. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Цай-Тэн, Т.; Чин-Чу, К.; Ли-Я, Л.; Ван-Пин, К.; Чунг-Куанг, Л.; Чиен-Чанг, С.; Чи-Ин, ВЧ; Чиен-Чи, К.; Шиао, Ю. Дж. Эринацин А-обогащенный мицелий Hericium erinaceus улучшает состояние патологий, связанных с болезнью Альцгеймера, у трансгенных мышей APPswe/PS1dE9. Дж. Биомед. наук. 2016 , 23 , 49. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Куо, ХК; Лу, CC; Шен, Швейцария; Тунг, Ю.Ю.; Се, MC; Ли, КЦ; Ли, Л.И.; Чен, CC; Дэн, CC; Хуанг, WS; и другие. Мицелий Hericium erinaceus и выделенный из него эринацин А. Защита от нейротоксичности, вызванной MPTP, посредством стресса ER, запускающего каскад апоптоза. Дж. Перевод. Мед. 2016 , 14 , 78. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Уэда, К.; Кодани, С.; Кубо, М.; Масуно, К.; Секия, А.; Нагай, К.; Кавагиши, Х. Соединения, подавляющие стресс эндоплазматической сети (ЭР), из остатков культивирования гриба Hericium erinaceum . Биология. Биотехнология. Биохим. 2009 , 73 , 1908–1910. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Кавагиси, Х.; Шимада, А.; Шираи, Р.; Окамото, К.; Одзима, Ф.; Сакамото, Х.; Исигуро, Ю.; Фурукава, С. Эринацины A, B и C, сильные стимуляторы синтеза фактора роста нервов (NGF), из мицелия Hericium erinaceum . Тетраэдр Летт. 1994 , 35 , 1569–1572. [ Академия Google ] [ CrossRef ]
- Цянь, ФГ; Сюй, ГЯ; Ду, С.Дж.; Ли, М.Х. Выделение и идентификация двух новых соединений пирона из культуры Herictum erinaceus . Яо Сюэ Сюэ Бао 1990 , 25 , 522–525. [ Академия Google ] [ PubMed ]
- Ван, К.; Бао, Л.; Ци, К.; Чжао, Ф.; Ма, К.; Пей, Ю.; Лю, Х. Erinacerins CL, изоиндолин-1-оны с ингибирующей α-глюкозидазу активностью из культур лекарственного гриба Hericium erinaceus . Дж. Нэт. Прод. 2015 , 78 , 146–154. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Швидерски, М.; Крузе, А. Каталитическое действие хлорида алюминия на примере превращения модельных соединений сахаров. Дж. Мол. Катал. 2015 , 402 , 64–70. [ Академия Google ] [ CrossRef ]
- Фан, CW; Ли, Г.С.; Хонг, SL; Вонг, Ю.Т.; Бркляча, Р.; Урбан, С.; Абд Малек, СН; Сабаратнам, V. Hericium erinaceus (Бюлл.: Фр.) Перс. культивирование в тропических условиях: выделение гериценонов и демонстрация NGF-опосредованного роста нейритов в клетках PC12 через сигнальные пути MEK/ERK и PI3K-Akt. Функция питания. 2014 , 5 , 3160–3169. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Виттштейн, К.; Рашер, М.; Рупчич, З.; Лёвен, Э.; Зима, Б.; Кестер, RW; Стадлер, М. Кораллоцины AC, метаболиты гриба Hericium coralloides , индуцирующие рост нервов и нейротрофический фактор головного мозга . Дж. Нэт. Прод. 2016 , 79 , 2264–2269. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Ланге-Картер, Калифорния; Джонсон, Г.Л. Ras-зависимая регуляция киназы MEK фактором роста в клетках PC12. Наука 1994 , 265 , 1458–1461. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Чао, М.В.; Хемпстед, BL p75 и Trk: система с двумя рецепторами. Тенденции Неврологии. 1995 , 18 , 321–326. [ Академия Google ] [ CrossRef ]
- Водри, Д.; Сторк, Пи Джей; Лазарович, П.; Эйден, Л.Е. Сигнальные пути для дифференцировки клеток PC12: создание правильных связей. Наука 2002 , 296 , 1648–1649. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Ван, З.; Лю, К.; Чжан, Р.; Лю, С.; Ся, З.; Ху, Ю. Каталпол улучшает вызванную бета-амилоидом дегенерацию холинергических нейронов за счет повышения нейротрофических факторов головного мозга. Нейронаука 2009 , 163 , 1363–1372. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Ченг, Л.Х.; Йе, Й.; Сян, Л.; Осада, Х.; Ци, Дж. Х. Линдерсин B из ракообразных Lindernia индуцирует нейрогенез путем активации сигнального пути тирозинкиназы А/фосфатидилинозитол-3-киназы/внеклеточного сигнал-регулируемого киназного пути. Фитомедицина 2017 , 24 , 31–38. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Чжао, Дж.; Ченг, ГГ; Фан, В.; Ян, CB; Да, Сан-Франциско; Кюи, В.; Вэй, В.; Лаос, LX; Кай, Дж.; Хан, Ю.Ф.; и другие. Растительный препарат пуэрарин координирует свои действия с фактором роста нервов в регуляции выживания нейронов и нейритогенеза посредством активации сигнальных путей ERK1/2 и PI3K/Akt в процессе расширения нейритов. Нейроны ЦНС. Там. 2015 , 21 , 61–70. [ Академия Google ] [ PubMed ]
- Джески, Р.; Чен, Х. Нейритогенный и нейропротекторный потенциал сенегенина против Aβ-индуцированной нейротоксичности в клетках PC 12. Дополнение БМК. Альтернативный. Мед. 2016 , 16 , 26. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Гао, Дж. М.; Шен, Дж.; Чжан, Алабама; Чжу, В.; Чжан, X.; Лю, Дж. К. Химические компоненты гриба Leccinum extremiorientale . Подбородок. Дж. Орг. хим. 2003 , 23 , 853–857. [ Академика Google ]
- Кубо, М.; Исии, Р.; Ишино, Ю.; Харада, К.; Мацуи, Н.; Акаги, М.; Като, Э.; Хосода, С.; Фукуяма, Ю. Оценка компонентов плодов Piper Retrofractum на нейротрофическую активность. Дж. Нэт. Прод. 2013 , 76 , 769–773. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Бай, Р.; Чжан, CC; Инь, Х.; Вэй, Дж.; Гао, Дж. М. Циатановые дитерпеноиды с нейротрофической активностью из культур грибов. Дж. Нэт. Прод. 2015 , 78 , 783–788.
